Methoden der Arbeitsgruppe
Zur Untersuchung der Anpassungsmechanismen und der Leistungsfähigkeit von Algen setzen wir unterschiedliche Freiland- und Labormethoden ein. Diese umfassen Taucharbeiten und in-situ Messungen verschiedener physiologischer und abiotischer Parameter. Unter kontrollierten Bedingungen im Labor führen wir ökophysiologische Untersuchungen zum Wachstum, zur Photosynthese und Respiration durch. Mit Hilfe mikroskopischer, biochemischer und molekularbiologischer Techniken können wir Algenarten identifizieren und deren Vitalität visualisieren, Stressmetaboliten quantifizieren und die zugrunde liegenden regulativen Prozesse beschreiben.
Physiologische Methoden
Wachstum integriert im Gegensatz zu Stoffwechselprozessen wie die Photosynthese den Einfluss aller positiven und negativen Umweltbedingungen, und repräsentiert somit den wichtigsten physiologischen Parameter zur Beschreibung der Leistungsfähigkeit. Mit Hilfe der in-vivo Chlorophyll Fluoreszenz kann das Wachstum bei geringsten Zelldichten schnell und zuverlässig ermittelt werden. Die Erhebung von Wachstumsraten unter verschiedenen abiotischen Umweltbedingungen ist somit ein wichtiger Schritt, Toleranzgrenzen, Optima und Anpassungsstrategien von Algen zu erfassen und zu bewerten.
GUSTAVS, L., SCHUMANN, R., EGGERT, A. & KARSTEN, U. (2009) In vivo growth fluorometry: accuracy and limits of microalgal growth rate measurements in ecophysiological investigations. Aquatic Microbial Ecology 55, 95-104. DOI: 10.3354/ame01291
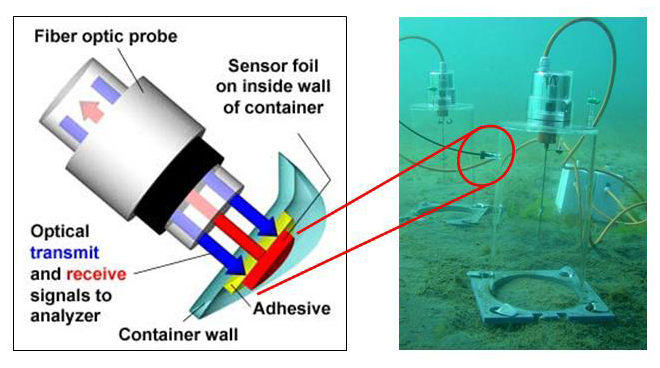
Zur Bestimmung von Photosynthese und Respiration sowie von Primärproduktion nutzen wir ein optisches Verfahren. Dabei werden Sauerstoffverbrauch im Dunkeln und Sauerstoffentwicklung unter ansteigenden Bestrahlungsstärken von Algen in temperierten Küvetten mittels Optoden gemessen. Im Freiland wird die Primärproduktion benthischer Diatomeen in einer benthischen Kammer on-line über optische Fasern erfasst. Die Kammern werden durch Taucher auf das Sediment gestülpt und dort verankert. Die eine Hälfte der Kammern wird durch natürliches Sonnenlicht bestrahlt, wodurch die Photosynthese der Diatomeen angetrieben wird. Die andere Hälfte der Kammern wird verdunkelt, um Respiration über eine stetige Abnahme der Sauerstoff-Konzentration zu verfolgen. Aus beiden Datensätzen lässt sich die Rate der Primärproduktion bezogen auf eine Fläche und einen Biomasseparameter berechnen. Weiterhin setzen wir verschiedene fluoreszenzbasierte PAM Systeme zur Bestimmung von Photosynthese-Parametern ein.
WOELFEL, J., EGGERT, A. & KARSTEN, U. (2014) Global warming could stimulate Arctic microphytobenthos primary production in Kongsfjorden (Svalbard, Norway) - in situ measurements and modelled changes. Marine Ecology Progress Series 501, 25–40.
Probenvorbereitung für biochemische Analysen
Gefriertrocknungsanlage mit kombiniertem SpeedVac-Evaporator
Analytische Methoden
Wir setzen verschiedene Hochleistungsflüssigkeitschromatographie (HPLC) Systeme ein, um Gemische von Stress-Metaboliten und anderer Substanzen zu trennen, und so weit wie möglich über Standards zu identifizieren und quantifizieren. Dabei liegt ein Schwerpunkt auf organischen Osmolyten (z.B. Polyolen), die in der Salz-Anpassung und Chemotaxonomie eine wichtige Rolle spielen. Weiterhin analysieren wir mykosporin-ähnliche Aminosäuren (MAAs), die in vielen Algen als spezifische Sonnenschutz-Substanzen wirken. Die vorhandenen HPLC Systeme können auch zur Analyse von organischen Säuren, Aminosäuren und Pigmenten eingesetzt werden.
KARSTEN, U., GÖRS, S., EGGERT, A. & WEST, J.A. (2007) Trehalose, digeneaside and floridoside in the Florideophyceae (Rhodophyta) – a re-evaluation of its chemotaxonomic value. Phycologia 46, 143-150.
DOI: 10.2216/06-29.1
KARSTEN, U., ESCOUBEYROU, K. & CHARLES, F. (2009) The effect of redissolution solvents and HPLC columns on the analysis of mycosporine-like amino acids (MAAs) in the macroalgal species Prasiola crispa and Porphyra umbilicalis. Helgoland Marine Research 63, 231-238. DOI: 10.1007/s10152-009-0152-0
Um die Elementzusammensetzungen unserer Freiland- und Experimentproben zu bestimmen, nutzen wir eine Vielzahl verschiedenere Geräte. Für partikuläre Bestandteile, z.B. aus Bodenkrusten, oder filtriertes partikuläres Material einer Wasserprobe, wird der Elementar Vario-EL Multi-Elementanalyser genutzt. Damit können Kohlenstoff- und Stickstoffkonzentrationen im Mikrogramm-Bereich simultan bestimmt werden.
Analysen von Kohlenstoff, Phosphor und Stickstoff im Mikrogrammbereich finden auch in der Biologischen Station Zingst statt (Kontakt Dr. Rhena Schumann). Mittels eines Niedrigtemperaturaufschlusses und eines Durchfluss-Analysers (Alliance Instruments) können Phosphat, Nitrat, Nitrit und Ammonium im Bereich von 0,05 – 10 µmol L-1 bestimmt werden. Die gesamte partikuläre und gelöste organische Kohlenstoff-Belastung, z.B. eines Gewässer, bestimmen wir mit dem Total Organic Carbon-Analyser (Shimadzu, TOC 5000A).
BERTHOLD, M., ZIMMER, D., SCHUMANN, R. (2015) A simplified method for total phosphorus digestion with potassium persulphate at sub-boiling temperatures in different environmental samples.Rostocker Meeresbiologische Beiträge, Vol. 25, pp. 7 - 25